Гипофосфит натрия
| Гипофосфит натрия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Гипофосфит натрия |
| Традиционные названия | фосфорноватистокислый натрий, фосфинат натрия |
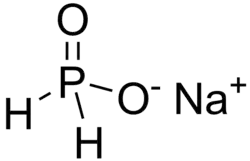
| Хим. формула | Na(PH2O2) |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | безводный = 87,98 г/моль; моногидрат = 105,99 г/моль |
| Плотность | безводный = 0,8г/см³, моногидрат = 1,8г/см³ |
| Химические свойства | |
| Растворимость | |
| • в воде | 8325; 554100 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7681-53-0 |
| PubChem | 101614877 |
| Рег. номер EINECS | 231-669-9 |
| SMILES | |
| InChI | |
| ChemSpider | 21241942 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гипофосфит натрия — неорганическое соединение, соль щелочного металла натрия и фосфорноватистой кислоты с формулой Na(PH2O2), бесцветные кристаллы, хорошо растворимые в воде, образует кристаллогидрат.
Получение
- Растворение белого фосфора в холодном концентрированном растворе едкого натра:
- Окисление фосфина гипохлоритом натрия:
- Нейтрализация щелочью фосфорноватистой кислоты:
- Разложение фосфината кальция карбонатом натрия:
Физические свойства
Гипофосфит натрия образует бесцветные кристаллы.
Хорошо растворяется в воде без гидролиза. Раствор имеет нейтральную реакцию.
Из водных растворов выделяется кристаллогидрат состава Na(PH2O2)•H2O, который плавится при 90°С в собственной кристаллизационной воде.
Растворяется в этаноле, плохо растворяется в жидком аммиаке.
Химические свойства
- При нагревании разлагается на пирофосфат натрия и метафосфат натрия:
- Безводная соль получается из кристаллогидрата при незначительном нагревании:
- Разлагается щелочами:
- Окисляется перекисью водорода:
- Используется, как мягкий восстановитель в органической химии[1] в реакциях восстановительного аминирования. Этот процесс обнаружен сотрудниками Лаборатории эффективного катализа (ЛЭК) ИНЭОС РАН.
Применение
- Восстановитель при нанесении покрытий из Ni, Co, Sn на металлы и пластмассы;
- Антиоксидант (предотвращает обесцвечивание алкидных смол при их получении);
- Стабилизатор ПВХ и полиуретанов;
- Реагент для фотометрического определения As(III) и Sb(III) и др.
Примечания
- ↑ Fedor Kliuev, Anton Kuznetsov, Oleg I. Afanasyev, Sofiya A. Runikhina, Ekaterina Kuchuk, Evgeniya Podyacheva, Alexey A. Tsygankov, Denis Chusov. Sodium Hypophosphite as a Bulk and Environmentally Friendly Reducing Agent in the Reductive Amination (англ.) // Organic Letters. — 2022-10-28. — Vol. 24, iss. 42. — P. 7717–7721. — ISSN 1523-7060. — doi:10.1021/acs.orglett.2c02807. Архивировано 8 декабря 2023 года.
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.