Сульфит лития
| Сульфит лития | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Сульфит лития |
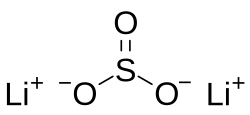
| Хим. формула | Li2SO3 |
| Физические свойства | |
| Молярная масса | 93.943 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 455 °C |
| • разложения | 455—800 °C |
| Классификация | |
| Рег. номер CAS | 13453-87-7 |
| PubChem | 11665397 |
| Рег. номер EINECS | 236-636-2 |
| SMILES | |
| InChI | |
| ChemSpider | 11358882 |
| Безопасность | |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфи́т ли́тия — неорганическое вещество, соль лития и сернистой кислоты с формулой Li2SO3.
Физические свойства
Сульфит лития — белое гигроскопичное кристаллическое вещество растворимое в воде, нерастворимое в этаноле [1].
Плавится с разложением при 455 °C. Образует кристаллогидраты состава Li2SO3•n H2O, где n = 1, 2 и 6. При осаждении из водных растворов и при поглощении влаги образует кристаллогидрат белого цвета с формулой Li2SO3•H2O, который разлагается, выделяя воду, при 190 °C [2].
Кристаллогидрат сульфита лития является пироэлектриком[3].
Химические свойства
Сульфит лития проявляет общие химические свойства, характерные для сульфитов щелочных металлов, а именно:
при нагревании дисмутирует на сульфид лития и сульфат лития
в водном растворе диссоциирует с образованием сульфит-аниона, который, гидролизуясь, создаёт осно́вную среду (pKb = 7,09)
при взаимодействии с сильными кислотами выделяется диоксид серы
при пропускании через раствор сульфита лития диоксида серы образуется гидросульфит лития
за счёт сульфит-аниона является восстановителем, например в реакции
Получение
Сульфит лития может быть получен пропусканием диоксида серы через насыщенный раствор гидроксида лития:
Применение
Примечания
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 281. — 637 с. — ISBN 978-5-358-01303-2.
- ↑ Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — С. 126. — 685 с. — ISBN 5-7107-8085-5.
- ↑ УКК по ЭТМ (Диэлектрические материалы) (недоступная ссылка)
Литература
- Плющев В. Е., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия. — М.: «Химия», 1970. — 408 с.