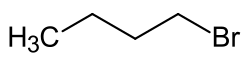
1-Бромбутан
| 1-Бромбутан | |
|---|---|
 | |
| Общие | |
| Хим. формула | C4H9Br |
| Физические свойства | |
| Молярная масса | 137,02 г/моль |
| Энергия ионизации | 10,13 эВ[1] |
| Термические свойства | |
| Температура | |
| • плавления | −112,4 °C |
| • кипения | 101,6 °C |
| Структура | |
| Дипольный момент | 6,9E−30 Кл·м[1] |
| Классификация | |
| Рег. номер CAS | 109-65-9 |
| PubChem | 8002 |
| Рег. номер EINECS | 203-691-9 |
| SMILES | |
| InChI | |
| RTECS | EJ6225000 |
| Номер ООН | 1126 |
| ChemSpider | 7711 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
1-Бромбутан представляет собой броморганическое соединение с формулой CH3(CH2)3Br. Бесцветная жидкость, хотя загрязнённые образцы кажутся желтоватыми. Не растворяется в воде, но растворим в органических растворителях. В основном используется в качестве источника бутильной группы в органическом синтезе. Это один из нескольких изомеров бутилбромида.
Получение
Получают по реакции радикального присоединения бромоводорода к бутену-1, протекающей как антимарковниковское присоединение.
1-Бромбутан также можно получить из бутанола-1 обработкой бромистоводородной кислотой[2]:
Химические свойства
Как первичный галогеналкан, он склонен к реакциям типа SN2. Обычно используется в качестве алкилирующего агента. При реакции с металлическим магнием в сухом эфире даёт соответствующий реактив Гриньяра. Такие соединения используются для присоединения бутильной группы к различным субстратам.
1-Бромбутан является предшественником в синтезе н-бутиллития[3]:
- , где X = Cl, Br
Литий, используемый в этой реакции, содержит 1-3 % натрия. Когда бромбутан является реагентом, продукт представляет собой гомогенный раствор, состоящий из смешанного кластера, содержащего как LiBr, так и LiBu.
Примечание
- 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Oliver Kamm, C. S. Marvel, R. H. Goshorn, Thomas Boyd, And E. F. Degering «Alkyl And Alkylene Bromides» Org.
- ↑ Brandsma, L. Preparative Polar Organometallic Chemistry I / Brandsma, L., Verkraijsse, H. D.. — Berlin : Springer-Verlag, 1987. — ISBN 3-540-16916-4.