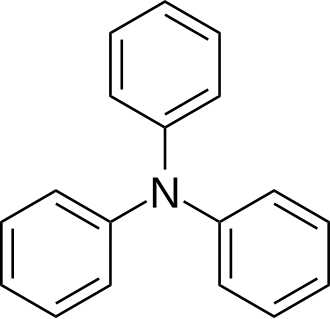
Трифениламин
| Трифениламин | |
|---|---|
  | |
 | |
| Общие | |
| Систематическое наименование |
N, N -дифениланилин |
| Хим. формула | C18H15N |
| Внешний вид | Кристаллы белого цвета |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 245,32 г/моль |
| Плотность | 0,77 ± 0,01 г/см³[1] |
| Энергия ионизации | 7,6 ± 0,1 эВ[1] |
| Термические свойства | |
| Температура | |
| • плавления | 261 ± 1 ℉[1] и 127 °C[2] |
| • кипения | 348 °C °C |
| • вспышки | 180 °C |
| Давление пара | 0,000392 мм. рт. ст. |
| Классификация | |
| Рег. номер CAS | 603-34-9 |
| PubChem | 11775 |
| Рег. номер EINECS | 210-035-5 |
| SMILES | |
| InChI | |
| RTECS | YK2680000 |
| ChemSpider | 11282 |
| Безопасность | |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Трифениламин — органическое соединение с формулой (C6H5)3N. Не является основанием, в отличие от большинства аминов. При комнатной температуре представляет собой бесцветное кристаллическое вещество с моноклинной структурой. Хорошо смешивается с диэтиловым эфиром и бензолом, но практически нерастворим в воде и частично в этаноле. Его производные обладают полезными свойствами электропроводности и электролюминесценции, они используются в органических светодиодах в качестве переносчиков дырок[3].
Трифениламин может быть получен путём арилирования дифениламина по Ульману[4].
Химические свойства
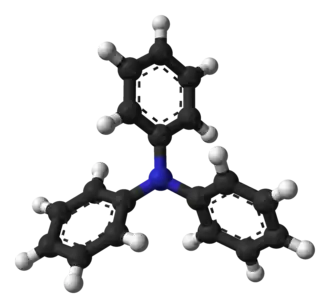
Трифениламин имеет три ароматические группы, непосредственно связанные с центральным атомом азота. Каждая ароматическая группа действует как электронный аттрактор, направляя к себе электронное облако неподелённой пары азота. При делокализации неподелённой пары азота[5] частичный положительный заряд передаётся азоту, уравновешиваемый частичным отрицательным зарядом, локализованным на ароматических группах. Такое расположение предотвращает протонирование азота — ключевой механизм придания раствору основности.
Из этой характеристики следует, что все три связи N-C (азот-углерод) лежат в одной плоскости и расположены под углом 120° друг к другу, что не относится к алифатическим аминам и аммиаку, где орбитали азота расположены в тетраэдре. Из-за стерических затруднений фенильные группы не находятся в одной плоскости, определяемой тремя связями N-C, а скручены, что придаёт молекуле характерную «пропеллероподобную» форму[6].
Примечания
- 1 2 3 http://www.cdc.gov/niosh/npg/npgd0643.html
- ↑ Bradley J., Williams A., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- ↑ Wei Shi, Suqin Fan, Fei Huang, Wei Yang, Ransheng Liu and Yong Cao "Synthesis of Novel Triphenylamine-based Conjugated Polyelectrolytes and Their Application to Hole-Transport Layer in Polymeric Light-Emitting Diodes" J. Mater. Chem., 2006, 16, 2387-2394. doi:10.1039/B603704F
- ↑ F. D. Hager "Triphenylamine" Org. Synth. 1928, 8, 116. doi:10.15227/orgsyn.008.0116
- ↑ T. Zhang, I. E. Brumboiu, C. Grazioli, A. Guarnaccio, M. Coreno, M. de Simone, A. Santagata, H. Rensmo, B. Brena, V. Lanzilotto, and C. Puglia "Lone-Pair Delocalization Effects within Electron Donor Molecules: The Case of Triphenylamine and Its Thiophene-Analog" J. Phys.
- ↑ Sobolev, A. N.; Belsky, V. K.; Romm, I. P.; Chernikova, N. Yu.; Guryanova, E. N. (1985). Structural investigation of the triaryl derivatives of the Group V elements. IX. Structure of triphenylamine, C18H15N. Acta Crystallographica Section C Crystal Structure Communications. 41 (6): 967–971. Bibcode:1985AcCrC..41..967S. doi:10.1107/S0108270185006217.