Трибутилфосфат
| Трибутилфосфат | |
|---|---|
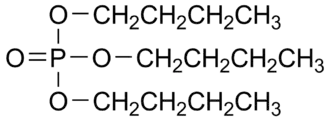 | |
| Общие | |
| Хим. формула | |
| Физические свойства | |
| Молярная масса | 266,32 г/моль |
| Плотность | 0,9766 г/см³ |
| Динамическая вязкость | 0,00339 Па·с |
| Термические свойства | |
| Температура | |
| • плавления | -90 °C |
| • кипения | 289 °C |
| • разложения | 552 ± 1 ℉[1], 289 °C[2] и 562 К[2] |
| • вспышки | 295 ± 1 ℉[1], 146 °C[2] и 419 К[2] |
| Давление пара | 0,004 ± 0,001 мм рт.ст.[1] |
| Оптические свойства | |
| Показатель преломления | 1,4249 |
| Классификация | |
| Рег. номер CAS | 126-73-8 |
| PubChem | 31357 |
| Рег. номер EINECS | 204-800-2 |
| SMILES | |
| InChI | |
| RTECS | TC7700000 |
| ChEBI | 35019 |
| ChemSpider | 29090 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Трибутилфосфат — трибутиловый эфир фосфорной кислоты (С4Н9О)3Р=О, относится к органическим фосфатам.
Физические и химические свойства
Трибутилфосфат — бесцветная жидкость, плохо растворима в воде (0,39 г/л при 19 °C), хорошо растворима в органических растворителях. Устойчива к гидролизу, к действию кислот, оснований, окислителей и восстановителей. В азотной кислоте медленно гидролизуется до ди- и монобутилфосфата. Начинает разлагаться выше 150°C, при 289°C кипит с разложением.
Получение и применение
Трибутилфосфат получают взаимодействием бутанола с POCl3 в органическом растворителе в присутствии органического основания, например, пиридина или триэтиламина. К другим способам его синтеза относятся реакция POCl3 с бутилатами натрия и алюминия и окисление трибутилфосфита.
Трибутилфосфат применяют в аналитической химии, радиохимии для разделения элементов, близких по свойствам трансурановым элементам, при переработке ядерного горючего, в производстве различных пластмасс, при производстве фармакологических препаратов из плазмы крови человека[3] и др.
Исследуя способы выделения урана методом экстракции с 1950 г., советский химик С.М. Карпачёва совместно со своим германским коллегой Максом Фольмером предложила использовать трибутилфосфат (ТБФ) для экстракции урана и плутония без добавок минеральных солей, из-за которых увеличивался объем отходов, а потом и применять синтин в качестве разбавителя. В 1955 году С. М. Карпачева с коллегами подготовили заявку на патент разработанной схемы применения ТБФ с синтином. Работы Карпачёвой положили начало внедрению ТБФ в советскую атомную промышленность[4].
Безопасность
Трибутилфосфат раздражает кожу и слизистые оболочки. ПДК в воздухе 2,5 мг/м3.
См. также
Примечания
- 1 2 3 http://www.cdc.gov/niosh/npg/npgd0625.html
- 1 2 3 4 https://www.cdc.gov/niosh/npg/npgd0625.html
- ↑ Кудашева Э.Ю., Борисевич И.В., Иванов В.Б., Климов В.И., Корнилова О.Г., Лебединская Е.В., Бунятян Н.Д. СОВРЕМЕННЫЕ ТЕХНОЛОГИЧЕСКИЕ ПОДХОДЫ К ОБЕСПЕЧЕНИЮ ВИРУСНОЙ БЕЗОПАСНОСТИ ПРЕПАРАТОВ ИММУНОГЛОБУЛИНОВ ЧЕЛОВЕКА. Научный журнал Успехи современного естествознания (2015).
- ↑ Карпачева Сусанна Михайловна / Персоналии // Эволюция отрасли /// История Росатома. Эволюция отрасли /// История Росатома. Дата обращения: 29 февраля 2024. Архивировано 29 февраля 2024 года.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
