Сульфосалициловая кислота
| Сульфосалициловая кислота | |
|---|---|
  | |
| Общие | |
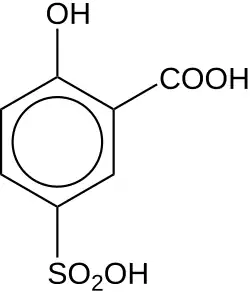
| Хим. формула | C7H6O6S |
| Физические свойства | |
| Молярная масса | 218,19 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 120 °C |
| Классификация | |
| Рег. номер CAS | 97-05-2 |
| PubChem | 7322 |
| Рег. номер EINECS | 202-555-6 |
| SMILES | |
| InChI | |
| ChEBI | 68555 |
| ChemSpider | 7046 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфосалициловая (2-гидрокси-5-сульфобензойная) кислота — ароматическая сульфоновая кислота.
Свойства
Сульфосалициловая кислота представляет собой бесцветные игольчатые кристаллы, хорошо растворимые в воде, ацетоне, этаноле и диэтиловом эфире. Кристаллизуется из воды в виде дигидрата с Tпл=120 °C. При нагревании выше температуры плавления сульфосалициловая кислота претерпевает термический распад, сопровождающийся выделением фенола и салициловой кислоты.
Химические свойства сульфосалициловой кислоты определяются наличием как ароматического ядра, так и карбоксильной и сульфогруппы, в частности, она вступает в реакции электрофильного замещения в ароматическое ядро.
Получение и применение
Синтез сульфосалициловой кислоты осуществляют реакцией салициловой кислоты с олеумом либо концентрированной серной кислотой в пятикратном избытке. Другой способ — гидролиз 5-салицилсульфохлорида.
Сульфосалициловая кислота применяется в аналитической химии как реагент для обнаружения и выделения ионов металлов (Fe, Al, Be, Hg, Ti, Zr, Tl, U), например, ион Fe3+ образует моносульфосалицилат розовато-бурого цвета (pH 1,8-2,5), дисульфосалицилат бурого цвета (pH 4-8), трисульфосалицилат жёлтого цвета (pH 8-11). Она также используется как маскирующий реагент для ряда ионов металлов и для определения ионов Fe, U, Be спектрофотометрическим методом. Поскольку сульфосалициловая кислота способна осаждать белки из растворов, то её применяют для их нефелометрического определения (в частности, альбумина в моче).
Сульфосалициловая кислота и её соли имеют антисептическое действие.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
- Лурье Ю. Ю. Справочник по аналитической химии. Издание 6-е переработанное и дополненное. — М.: Химия, 1989. — 448 с. — ISBN 5-7245-0000-0.