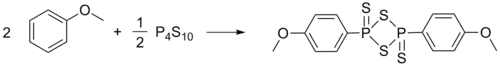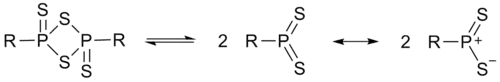Реагент Лавессона
| Реагент Лавессона | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
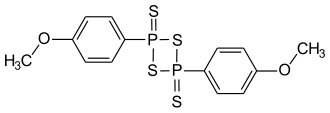
2,4-бис(4-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дисульфид |
| Сокращения | LR |
| Традиционные названия | Реагент Лавессона |
| Хим. формула | C14H14O2P2S4 |
| Физические свойства | |
| Молярная масса | 404.45 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 223 °C[1] |
| Классификация | |
| Рег. номер CAS | 19172-47-5 |
| PubChem | 87949 |
| Рег. номер EINECS | 242-855-4 |
| SMILES | |
| InChI | |
| ChemSpider | 79346 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
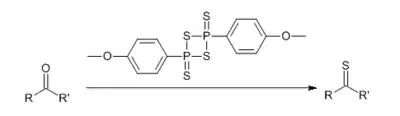
Реагент Лавессона (реактив Лоуссена) — замещенный дитиофосфетан, использующийся в качестве тионирующего агента в органическом синтезе:
Представляет из себя желтоватые гигроскопичные кристаллы с неприятным запахом (гидролизуется с выделением сероводорода), растворимые при нагревании в ароматических растворителях (толуол, хлорбензол, анизол) и диметоксиэтане, слаборастворимые в эфире[2].
Впервые был синтезирован в 1956 г. в ходе исследования реакций пентасульфида фосфора P4S10 с ароматическими соединениями[3], в синтетическую практику в качестве тионирующего агента введен Свеном-Олафом Лавессоном.
Синтез
Реагент Лавессона синтезируют взаимодействием эквивалентных количеств пентасульфида фосфора и анизола, реакция идёт при нагревании с обратным холодильником при температуре кипения анизола, реактив Лавессона кристаллизуется при охлаждении реакционной смеси. Выход (без перекристаллизации) составляет 79-87 %[4]:
Продукт может быть дополнительно очищен перекристаллизацией из кипящего толуола[2], однако в большинстве случаев может использован для тионирования без перекристаллизации.
Механизм тионирования
Реагент Лавессона в растворе существует в равновесии с образующимся из него нуклеофильным дитиофосфинилидом:
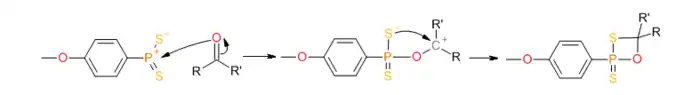
Реакция карбонила с этим илидом ведет к образованию тиаоксофосфетанового интермедиата:
который затем распадается с образованием тиокарбонильного соединения:
Механизм реакции сходен с механизмом реакции Виттига, в обоих случаях происходит образование четырёхчленного интермедиата со связью P-O и движущей силой реакции является образование высокостабильной связи P=O.
Синтетическое применение
Реагент Лавессона применяют для тионирования кетонов, амидов и лактамов. Лактоны также могут быть тионированы и некоторые сложные эфиры (например, этиловый эфир пирослизевой кислоты)[5], однако сложные эфиры алифатических карбоновых кислот тионируются с низкими выходами.
Выходы при тионировании N,N-дизамещенных амидов колеблются от высоких (например, при тионировании N-метилпирролидона выход количественный[4]) до низких, в последнем случае вместо использования реагента Лавессона предпочтительней использование реагента Дэвиса, который дает высокие выходы N,N-дизамещенных амидов[6].
Реакция с 1,4-дикарбонильными соединениями ведет к образованию тиофенов[7]. Аналогично идет реакция с их аза-аналогами, так, амиды α-амино-β-кетокислот под действием реагента Лавессона образуют тиазолы[8].
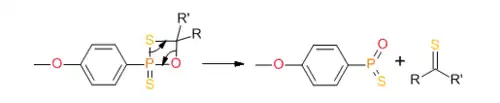
Реагент Лавессона также применяется для тионирования фосфиноксидов с образованием фосфинсульфидов[9]:
- R3P=O + LR R3P=S
См. также
Литература
Jesberger, Martin; Davis, Thomas P.; Barner, Leonie (Сентябрь 2003). Applications of Lawesson's Reagent in Organic and Organometallic Syntheses. Synthesis. 2003 (13): 1929–1958. doi:10.1055/s-2003-41447. eISSN 1437-210X. ISSN 0039-7881. Дата обращения: 3 февраля 2021.
Примечания
- ↑ Bradley J., Williams A., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- 1 2 Voss, Jürgen. 2,4-Bis(4-methoxyphenyl)-1,3,2,4-dithiadiphosphetane 2,4-Disulfide // Encyclopedia of Reagents for Organic Synthesis / Jürgen Voss, Jürgen Voss. — American Cancer Society, 2006. — ISBN 978-0-470-84289-8.
- ↑ Lecher, H. Z.; Greenwood, R. A.; Whitehouse, K. C.; Chao, T. H. (1956). The Phosphonation of Aromatic Compounds with Phosphorus Pentasulfide. J. Am. Chem. Soc. 78 (19): 5018. doi:10.1021/ja01600a058.
- 1 2 Thiation with 2,4-bis(4-methoxyphenyl)-1,3,2,4- dithiadiphosphetane 2,4-disulfide: N-Methylthiopyrrolidone. Organic Syntheses. 62: 158. 1984. doi:10.15227/orgsyn.062.0158. eISSN 2333-3553. ISSN 0078-6209. Архивировано 8 февраля 2021. Дата обращения: 3 февраля 2021.
- ↑ Varma, Rajender S.; Kumar, Dalip (Сентябрь 1999). Microwave-Accelerated Solvent-Free Synthesis of Thioketones, Thiolactones, Thioamides, Thionoesters, and Thioflavonoids. Organic Letters. 1 (5): 697–700. doi:10.1021/ol990629a. eISSN 1523-7052. ISSN 1523-7060. Архивировано 19 июля 2019. Дата обращения: 3 февраля 2021.
- ↑ Heimgartner, Heinz. 1,3,2,4-Dithiadiphosphetane, 2,4-bis[(4- methylphenyl)thio-2,4-disulfide] // Encyclopedia of Reagents for Organic Synthesis. — American Cancer Society, 2003. — ISBN 978-0-470-84289-8. Архивная копия от 8 февраля 2021 на Wayback Machine
- ↑ Minetto, Giacomo; Raveglia, Luca F.; Sega, Alessandro; Taddei, Maurizio (2005). Microwave-Assisted Paal–Knorr Reaction – Three-Step Regiocontrolled Synthesis of Polysubstituted Furans, Pyrroles and Thiophenes. European Journal of Organic Chemistry. 2005 (24): 5277–5288. doi:10.1002/ejoc.200500387. ISSN 1099-0690. Дата обращения: 3 февраля 2021.
- ↑ Sanz-Cervera, Juan F.; Blasco, Raül; Piera, Julio; Cynamon, Michael; Ibáñez, Ignacio; Murguía, Marcelo; Fustero, Santos (4 декабря 2009). Solution versus Fluorous versus Solid-Phase Synthesis of 2,5-Disubstituted 1,3-Azoles. Preliminary Antibacterial Activity Studies. The Journal of Organic Chemistry. 74 (23): 8988–8996. doi:10.1021/jo9016265. eISSN 1520-6904. ISSN 0022-3263. Дата обращения: 3 февраля 2021.
- ↑ Wang, Xian-Liang; Chen, Jin-Xiang; Jia, Xue-Shun; Yin, Liang (Январь 2020). Synthesis of α,β-Unsaturated Phosphine Sulfides. Synthesis. 52 (01): 141–149. doi:10.1055/s-0039-1690685. eISSN 1437-210X. ISSN 0039-7881. Дата обращения: 3 февраля 2021.