Пероксид лития
| Пероксид лития | |
|---|---|
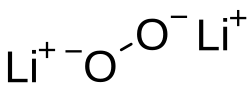 | |
| Общие | |
| Систематическое наименование |
Пероксид лития |
| Традиционные названия | Перекись лития |
| Хим. формула | Li2O2 |
| Рац. формула | Li2O2 |
| Физические свойства | |
| Молярная масса | 45,881 г/моль |
| Плотность | 2,363 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 198 °C |
| Классификация | |
| Рег. номер CAS | 12031-80-0 |
| PubChem | 25489 |
| Рег. номер EINECS | 234-758-0 |
| SMILES | |
| InChI | |
| ChemSpider | 23787 и 21489577 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Пероксид лития — соединение щелочного металла лития и кислорода. Химическая формула Li2O2.
Получение
Пероксид лития получают взаимодействием перекиси водорода и гидроокиси лития в этаноле:
Для получения безводного продукта, кристаллогидрат необходимо долго сушить в вакууме над P2O5.
Физические свойства
Пероксид лития представляет собой мелкие белые кристаллы, тетрагональной сингонии, параметры ячейки a = 0,548 нм, c = 0,774 нм, Z = 8.
Химические свойства
При нагревании пероксид лития не плавясь разлагается:
Взаимодействует с водой (по-разному при разных температурах):
Реакция с кислотой тоже зависит от температуры:
Поглощает углекислоту из воздуха:
С угарным газом при нагревании образует карбонат:
Применение
Пероксид лития служит добавкой к стеклам, глазурям и эмалям для повышения их термостойкости, уменьшения вязкости расплавов и коэффициента термического расширения, а также в поглотителях углекислоты, используемых в космических кораблях.
Биологическая роль
Пероксид лития Li2O2 (перекись лития) по степени воздействия на человеческий организм относится к 3-му классу опасности (умеренно-опасные). В больших количествах опасен для окружающей среды.
Литература
- Гринвуд, Норман Н., Ерншоу, А., Химия в элементах, 1997, ISBN 0-7506-3365-4
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Химические свойства неорганических веществ: Учеб. пособие для вузов — 3-е изд., испр — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
